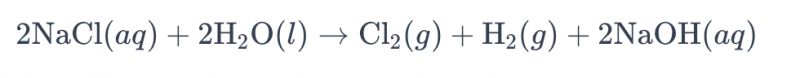O processo de eletrólise de uma solução salina utilizando eletrodos de titânio para produzir cloro é comumente denominado "eletrólise de salmoura". Nesse processo, eletrodos de titânio são empregados para facilitar a reação de oxidação dos íons cloreto na salmoura, levando à geração de gás cloro. A equação química geral da reação é a seguinte:
Nessa equação, os íons cloreto sofrem oxidação no ânodo, resultando na produção de gás cloro, enquanto as moléculas de água são reduzidas no cátodo, produzindo gás hidrogênio. Além disso, os íons hidróxido sofrem redução no ânodo, formando gás hidrogênio e hidróxido de sódio.
A escolha de eletrodos de titânio se deve à excelente resistência à corrosão e condutividade do titânio, permitindo que a reação ocorra de forma estável durante a eletrólise, sem sofrer corrosão. Isso torna os eletrodos de titânio uma escolha ideal para a eletrólise de salmoura.
A eletrólise da água salina normalmente requer uma fonte de energia externa para fornecer energia à reação eletrolítica. Essa fonte de energia geralmente é uma fonte de corrente contínua (CC), pois as reações eletrolíticas exigem uma direção constante do fluxo de corrente, e uma fonte de alimentação CC pode fornecer uma corrente constante.
No processo de eletrólise da água salina para gerar gás cloro, é comum o uso de uma fonte de alimentação CC de baixa tensão. A tensão da fonte de alimentação depende das condições específicas da reação e do projeto do equipamento, mas geralmente varia entre 2 e 4 volts. Além disso, a intensidade da corrente da fonte de alimentação é um parâmetro crucial que precisa ser determinado com base no tamanho da câmara de reação e no rendimento de produção desejado.
Em resumo, a escolha da fonte de alimentação para a eletrólise da água salina depende dos requisitos específicos dos experimentos ou processos industriais para garantir uma reação eficiente e a obtenção dos produtos desejados.
Data da publicação: 16 de janeiro de 2024